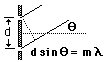Experimento casero
Si tienes una caja de cartón, un disco CD viejo que no te importe romper y un cutter, prepárate para hacer un experimento en el que vas a aprender un montón de física cuántica. Prometo no usar ni una fórmula, así que espero que disfrutes el artículo aunque odies las mates.
Hace poco más de un siglo que sabemos con absoluta certeza que las distintas sustancias que se encuentran en la Naturaleza se pueden partir una y otra vez manteniendo sus propiedades, pero no hasta el infinito: el límite es lo que llamamos átomos, del griego ἄ-τομος "in-divisible".
Seguramente en la escuela te explicaron que los átomos consisten en un núcleo, compuesto de partículas llamadas protones y neutrones (de cargas positiva y neutra) y una nube de electrones de carga negativa orbitando a su alrededor, tal que así:
Pues bien, si esta imagen de un mini sistema solar es la que tenías en mente cuando piensas en un átomo, siento decirte que... ¡¡en el colegio te engañaron!!. Por suerte, un átomo es algomuchísimo más complejo y entretenido, y una de las razones es el tamaño de las partículas que lo componen. Los electrones son tan "pequeños" y ligeros (pesan unas 1800 veces menos que las partículas del núcleo atómico) que viven en el mundo microscópico donde las leyes de la Naturaleza son muy diferente a las que vemos en nuestro día a día: las de la mecánica cuántica.
Para empezar, un electrón no es una "bolita", como se lo suele representar. Se descartó hace mucho tiempo que pudieran ser esferas tras analizar un efecto llamado spin. De hecho, a día de hoy no se sabe qué son por dentro (si es que son algo).
Pero tampoco es correcto imaginárselos como "puntos" infinitamente pequeños y sin dimensión. En el mundo de la mecánica cuántica la pregunta de qué es un electrón quieto, sobre la mesa, no tiene sentido, ya que un electrón quieto no existe: debido al principio de indeterminación(que no de incertidumbre) ningún objeto puede estar quieto, aunque el efecto se atenúa para objetos más grandes que moléculas y por eso nuestra experiencia cotidiana no lo nota. Cuanto más intentes dejar un electrón quieto, más se moverá. De hecho, gracias a dicho efecto existe la materia tal y como la conocemos ya que así se evita que los electrones caigan hacia el núcleo atómico, al que se sienten atraídos por la diferencia de carga eléctrica (ya lo demostré matemáticamente aquí).
El hecho es que un electrón es en realidad un ente difuso, extremadamente pequeño pero que no está en ningún sitio concreto sino en una zona del espacio determinada siguiendo lo que llamamos funciones de densidad de probabilidad (fdp) que nos dicen donde es más o menos probable encontrar al electrón. Por ejemplo, en un átomo de Helio, sus dos electrones orbitarán normalmente siguiendo idénticas distribuciones de probabilidad esféricas, siendo más probable encontrarlos cerca del núcleo que lejos:
Pero ojo: a diferencia de las estadísticas que se usan en aspectos más mundanos como cuando se acota la incertidumbre o error en encuestas y sondeos antes de unas elecciones, en el caso de los electrones la nube que estás contemplando arriba es realmente el electrón en sí.
Está en todos esos lugares... a la vez.
Han corrido ríos de tinta en debates filosóficos sobre las implicaciones de que la materia no esté bien definida (el problema del colapso de la función de onda), así que no voy ni a intentar ahondar en el debate aquí. La Naturaleza es así de extraña, no hay que intentar buscarle más explicaciones porque es posible que nunca encontremos una explicación más fundamental. En este aspecto la mecánica cuántica está muy cerca del "razonamiento de madre" frente a un crío pesado: "¿Pero por qué, pero por qué? ¡Porque sí, y punto!".
Hasta ahora, ya hemos visto que el modelo de mini sistema solar del átomo es incorrecto en el aspecto de que los electrones siguen distribuciones de probabilidad en lugar de órbitas perfectas cual pequeños planetitas. Pero hay algo más fundamental. En un sistema solar, las posiciones de los planetas son arbitrarias, dependientes de accidentes de la historia.
En el átomo no es así: en todos los átomos de hidrógeno el electrón orbita en una distribución de probabilidad idéntica. En todos los átomos de hidrógeno del universo. Si fuera coincidencia, ¡sería la madre de todas las casualidades!. Pero obviamente no es casualidad, sino otra ley de la naturaleza, y la que da nombre a la física cuántica: la energía de un electrón no puede tener cualquier valor, sino que sólo puede dar "saltitos" de unos valores determinados.
A estos "saltitos" se les llamó "cuantos" de energía porque quedaba más serio, y así nació la mecánica cuántica a principios del siglo XX. Lo curioso es que el "tamaño" de la órbita que sigue un electrón cuando está atado a un átomo depende exclusivamente de su nivel de energía lo que se llama el "número cuántico n", y dentro de cada nivel energético concreto puede describir órbitas de distintas formas geométricas dependiendo de otros dos números discretos los "números cuánticos m y l ". Para hacerse una idea de qué pinta tienen estas distribuciones de probabilidad, llamadas orbitales atómicos, échale un ojo a la siguiente tabla para el caso del electrón del átomo de hidrógeno
Inmediatamente llegamos por fin al meollo de la cuestión del experimento de hoy: ¿para qué sirven los niveles de energía? Es un hecho que cuando un átomo tiene más de dos electrones, estos parecen "chocar" y egoístamente compiten por los niveles más bajos negándose a compartirlo los unos con los otros, con lo que si un electrón llega tarde tendrá que ocupar el siguiente hueco de energía que quede libre siguiendo una serie de complejas reglas. El mecanismo, que es la base misma de que exista la química, se llama principio de exclusión de Pauli. Aunque ponerle un nombre es algo muy distinto a conocer el por qué ocurre.
Por tanto, tenemos ya una imagen del átomo lo suficientemente verídica para el experimento que nos proponemos hacer, que no es otro que analizar la emisión de luz por parte de átomos. En concreto, de la luz que emiten las bombillas de una casa.
Y aquí tenemos que distinguir entre dos tipos radicalmente distintos de bombillas: las "antiguas" o clásicas lámparas de hilo incandescente se basan como su nombre indican en calentar mucho un hilo hasta que llega a tal temperatura que empieza a brillar. Este mecanismo se llama radiación térmica, y se caracteriza porque la "combinación de colores" que un objeto emite depende casi únicamente de su temperatura, no del material ni de la manera en que se ha calentado. Matemáticamente, la "combinación de colores" se representa mediante un espectro de emisión, una gráfica que nos dice cuanta luz se emite en cada color (o longitud de onda λ, o frecuencia: los tres conceptos son sinónimos):
Es decir: en lámparas incandescentes se emite luz en un rango continuo de longitudes de onda.
Por otro lado tenemos las lámparas de tipo fluorescentes (tubos o las más pequeñas y modernas CFL). ¡Estas son mucho más interesantes! Todas estas lámparas funcionan por el mismo principio: se hace pasar una corriente de electrones libres desde un extremo del tubo al otro, y estos electrones en su camino chocan contra átomos del vapor de mercurio que las rellena:
En cada uno de estos choques ocurre algo muy interesante: el electrón libre que venía a toda velocidad pierde la energía cinética su "velocidad" y se la transfiere a uno de los 80 electrones que hay en cada átomo de mercurio. Según las reglas de la mecánica cuántica, un electrón solo puede aceptar ciertas cantidades (cuantos) de energía, que coinciden precisamente con los "escalones" que tiene que escalar hacia niveles de orbitales más altos.
Se dice entonces que el electrón está "excitado", y realmente no aguanta mucho tiempo en ese estado hasta que vuelve a caer a su hueco natural. Como la energía ni se crea ni se destruye, la energía que le sobra al caer la emite en forma de un fotón, un "paquetito de luz", cuya longitud de onda o color depende exclusivamente del tamaño del escalón en la caída.
La siguiente figura te ayudará a entender todo esto para el ejemplo sencillo de un átomo de hidrógeno con un sólo electrón:
Se puede predecir por tanto que un átomo que emita radiación por medio de electrones excitados sólo podrá hacerlo a unas determinadas longitudes de onda muy precisas(obviando el efecto Zeeman y otros detalles). De hecho, estas longitudes se pueden visualizar como distintos colores en el espectro visible en forma de "rayas" y caracterizan a cada elemento químico ya que dependen de la configuración de sus electrones. La siguiente foto es el espectro emitido por un gas de hidrógeno al hacerle pasar una descarga eléctrica, y se ven claramente las líneas correspondientes a los saltos 5->2, 4->2 y 3->2 (repasa el dibujo de arriba):
Volviendo a nuestro caso de la lámpara fluorescente, el vapor de mercurio realmente emite principalmente en dos líneas espectrales (60% a 253.7nm y 10-20% en 185nm) que caen en elultravioleta, y por lo tanto son invisibles a nuestros ojos. Por eso el interior de dichas lámparas va recubierto de sustancias químicas especialmente pensadas para absorber dicha radiación, que sus electrones salten varios niveles de golpe, y luego caigan poco a poco, emitiendo paquetes de radiación de menor energía (y por tanto, mayor longitud de onda) en cada saltito. Este fenómeno se llama fluorescencia y es la razón del nombre de dichas lámparas.
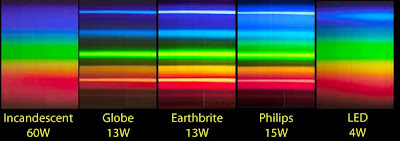
Dependiendo del fabricante de la lámpara fluorescente y del material de recubrimiento, el número de saltos será mayor o menor y estarán en distintas longitudes de onda, aunque para la mayoría de modelos "económicos" tienen prácticamente el mismo espectro de emisión:
Las líneas discretas que se ven en las tres lámparas fluorescentes centrales representan los distintos saltos de electrones de los que hemos hablado arriba.
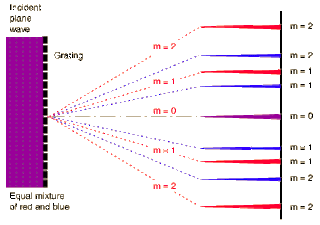
El objetivo del experimento de hoy es ser capaces de ver dicho espectro para detectar las líneas espectrales de las lámparas que tengáis en casa. En un laboratorio profesional se usaría una red de difracción, básicamente una superficie fina con un patrón regular de agujeros microscópicos:
La distancia entre agujeros debe ser del orden de magnitud de la luz que se quiere analizar y lo que se consigue es separar la luz en sus distintos colores de una forma mucho más eficiente a como lo haría un prisma. Para detectar la separación habrá que mirar el patrón desde un ángulo que coincida con los puntos señalados como "m=1" en el dibujo.
Como es raro que alguien tenga un patrón de difracción de laboratorio en su casa, vamos a usar algo mucho más artesanal: un CD. Incluso un CD-R (de los grabados en casa) vale, ya que aunque esté vacío vienen con una serie de surcos de ~500nm de ancho ya pregrabados:
Al no ser agujeros sino surcos la difracción no será perfecta sino que dependerá del ángulo con el que se mire... ¡pero esto es un experimento casero, así que nos conformamos!
Lo primero que hay que hacer es quitarle la cubierta que lleve pegada en uno de sus lados. Esto debe hacerse con un cutter y con mucho cuidado para no rallarlo. Recomiendo cortar un trozo sin preocuparse y a partir de ahí ir levantándolo muy lentamente introduciendo el cutter por debajo:
Tras separar la cubierta de un trozo, procedemos a cortarlo con unas tijeras:
Y a continuación buscamos una caja de cartón y haremos una pequeña ranura en uno de los extremos, y colocaremos el trozo de CD sin cobertura de forma que haga un cierto ángulo con un rayo de luz que entre en la caja, tal que así:
El último paso recomendable es cerrar la caja con su tapa y abrir una pequeña ventana por la que poder ver el trozo de CD desde arriba. Deberás probar para averiguar el ángulo de refracción correcto. También hay otras posibles configuraciones (con el CD paralelo a la abertura y el visor en la otra punta, etc...): prueba y descubre la que te parezca más cómoda.
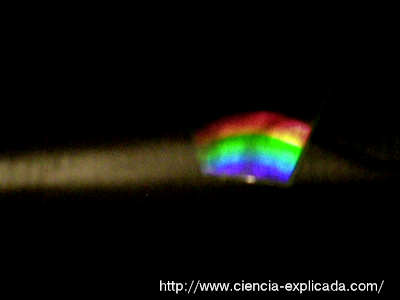
Tras todo esto, ya podemos iluminar la caja a través de la ranura con el tipo de luz a analizar y podremos ver su espectro a través de la ventana. Primero os muestro lo que se ve con una lámpara incandescente (¡¡perdón por la calidad de esta imagen!!):
Como era de esperar, se ve un espectro continuo, lo que corresponde al tipo de emisión térmico.
Pero si ahora enfocamos una lámpara fluorescente hacia nuestro rudimentario analizador, veremos esta preciosa imagen:
Cada una de esas líneas representa los saltos discretos de los electrones de la cubierta del tubo fluorescente. Compáralos con los espectros de bombillas de distintas marcas que mostré arriba y verás como son idénticos.
¡¡esas rayitas tan tontas son la verificación palpable de que el mundo está hecho de átomos que se rigen por las reglas de la mecánica cuántica!!.
La física puede ser maravillosa, ¿o no?